Strålebehandling er en av de mest brukte metodene for å behandle kreft. Mer enn halvparten av alle kreftpasienter i verden får denne typen behandling, og det er ikke tilfeldig. Det som gjør stråling så effektiv, er at den angriper kreftceller på en måte de ikke kan overleve - ved å ødelegge deres DNA. Men hvordan skjer det egentlig? Og hvorfor dør kreftceller, mens sunne celler ofte klarer å overleve?
Hvordan stråling ødelegger DNA i kreftceller
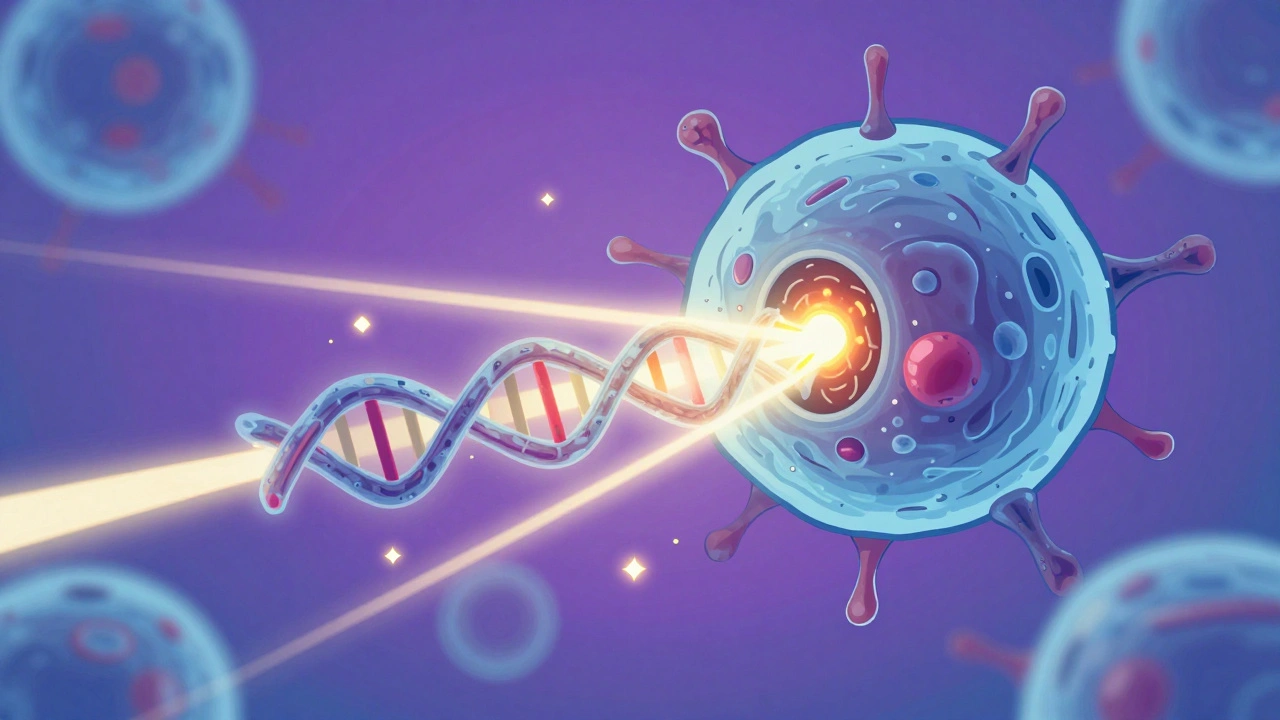
Strålebehandling bruker høyenergetiske partikler eller bølger - som røntgenstråler eller elektroner - for å treffe celler i kroppen. Når disse strålene treffer en celle, skjer det noe som kalles ionisering. Det betyr at strålingen ryker ut elektroner fra atomer i cellen, og dette fører til at molekyler som DNA blir skadet.
Den mest dødelige typen skade er dobbeltstrengsbrudd i DNAet. Hvis DNAet bare har ett brudd, kan cellen ofte reparere det. Men når begge trådene i DNA-trappen er brudd, blir det mye vanskeligere. Kreftceller har ofte allerede dårlig reparasjonskapasitet, og dobbeltstrengsbrudd overvelder dem. Det er som å kutter begge endene på en loddrett streng - den kan ikke lenger brukes til å lage nye celler.
Strålingen skaper også reaktive oksygenstoffer (ROS) i cellen. Disse er ustabilt og angriper alt de treffer: fett i cellehinnene, proteiner og selvfølgelig DNA. Det hele fører til en kjemisk kaos som cellen ikke klarer å håndtere. Enkelte celler dør umiddelbart. Andre klarer å overleve i noen timer eller dager, men når de prøver å dele seg, går det galt. De har ikke riktig DNA, og da dør de i en prosess kalt mitotisk katastrofe.
Hva skjer i cellen etter stråling?
Når DNA blir skadet, aktiverer cellen en alarm. To kjemiske sensorer, kalt ATM og ATR, oppdager skaden og setter i gang en hel kjede av reaksjoner. Denne kjeden kalles DNA-skaderespons (DDR). Denne responsen stopper cellen i sin deling, for å gi den tid til å reparere skaden.
Det finnes to hovedmetoder for å reparere dobbeltstrengsbrudd: ikke-homolog endjoining (NHEJ) og homolog rekombinasjon (HR). NHEJ er rask, men upresis - den klistrer endene sammen igjen, selv om det kan bli feil. HR er mer nøyaktig, men krever en hel, uskadet DNA-tråd som mal. Kreftceller med mutasjoner i BRCA1 eller BRCA2 - som ofte finnes i bryst- og eggstokkkreft - har svært dårlig HR. Det gjør dem mer sårbare for stråling.
Men her kommer en ny, viktig oppdagelse: Det er ikke bare hvordan cellen dør som teller - det er også hvordan den dør. Hvis cellen bruker HR for å reparere seg, dør den stille under deling - uten å varsle kroppen. Men hvis den bruker NHEJ eller ikke klarer å reparere seg, slipper den ut signaler som minner om en infeksjon. Det aktiverer immunsystemet. Det betyr at stråling ikke bare dreper celler - den kan også vise dem til immunsystemet som en målsetting.

Hvordan stråling aktiverer immunsystemet
Det er ikke bare DNA-skaden som virker. Stråling gjør også at kreftceller viser mer av sine egne proteiner på overflaten. Disse proteinene kalles antigener, og de fungerer som «søkemerkene» for immunsystemet. Når cellen er strålet, blir flere av disse merkene synlige, og immunsystemet får lettere øye på dem.
Enkelte studier har vist at stråling kan øke antallet antigener som presenteres på MHC-I-molekyler - de molekylene som forteller immunsystemet hva som er «eksternt» og hva som er «egen». Dette gjør kreftcellene mer synlige. I noen tilfeller, spesielt når stråling brukes i høye doser (som i SBRT), skjer det også at blodårene i svulsten skades. Dette fører til at celler i svulsten blir sultet på oksygen - og da dør de. Og når de dør, slipper de ut enda flere signaler som trekker inn immunceller.
Dette er grunnen til at strålebehandling nå ofte kombineres med immunterapi. I en studie med pasienter med utbredt lungekreft, økte responsraten fra 22 % til 36 % når stråling ble lagt til med immunmedisinen pembrolizumab. Det er ikke bare en tilfeldig forbedring - det er et systematisk resultat av at stråling gjør kreftcellene mer «synlige» for immunsystemet.
Hvorfor dør noen celler og ikke andre?
Ikke alle kreftceller dør like lett. Noen har utviklet motstand. En av de vanligste årsakene er at de har forbedret sin evne til å reparere DNA. Hvis en celle kan reparere dobbeltstrengsbrudd raskt, klarer den å overleve. Det er derfor pasienter med høyt nivå av 53BP1 - et reparasjonsprotein - ofte svarer dårligere på stråling. De har en effektivere reparasjonsmaskineri.
En annen viktig faktor er oksygen. Kreftceller i svulstens sentrum er ofte hypokse - det vil si de har lite oksygen. Oksygen gjør stråling mye mer effektiv. Cellene med god oksygentilførsel trenger nesten tre ganger mindre stråling for å dø enn cellene i hypokse områder. Det er en av grunnene til at store, tette svulster ofte er vanskeligere å behandle.
Det finnes også celler som bare venter. De går i hvile - i G0-fasen av cell syklusen - og unngår deling. Stråling virker best mot celler som er i ferd med å dele seg. Så hvis en celle er i hvile, kan den overleve og senere begynne å dele seg igjen. Det er en av grunnene til at strålebehandling ofte gis over flere uker - for å få alle cellene til å komme ut av hvilen og bli sårbare.

Hvordan moderne teknologi reduserer skade på sunne celler
Det har vært en stor endring i strålebehandling de siste 20 årene. Tidligere ble stråling sendt inn fra få retninger, og det var vanskelig å unngå sunne vev. I dag bruker vi teknikker som IMRT (intensitetsmodulert strålebehandling) og SBRT (stereotaktisk kroppstrålebehandling). Disse metodene bruker datamaskiner og kameraer for å rette strålingen med nøyaktighet på under én millimeter.
En moderne lineær akselerator kan endre stråleformen i sekundene, slik at den følger svulstens form som en skreddersydd jakke. Det betyr at vi kan gi høyere doser til svulsten, og samtidig redusere skaden på nerver, tarm, lunger eller andre viktige organer. I noen tilfeller gir vi stråling i bare én eller fem behandlinger - i stedet for 20-30. Det er mulig fordi vi nå vet mye bedre hvor vi skal treffe.
Det finnes også en ny teknologi kalt FLASH-strålebehandling. Den sender ut hele dosen på mindre enn en sekund - med en hastighet over 40 grays per sekund. I dyrestudier har det vist seg at dette reduserer skaden på sunne celler, mens kreftcellene fortsatt dør. De første forsøkene på mennesker startet i 2020, og resultatene er lovende.
Hva er fremtiden for strålebehandling?
Fremtiden ligger i kombinasjoner. Ikke bare stråling alene, men stråling pluss immunterapi, pluss DNA-reparasjonshemmere som PARP-hemmere. For pasienter med BRCA-mutasjoner, kan kombinasjonen av stråling og olaparib øke overlevelsen betydelig. Forskere tester også hvordan man kan bruke kunstig intelligens til å forutsi hvordan en svulst vil reagere - og tilpasse stråledosen i sanntid.
Det som er nytt, er at vi ikke lenger ser stråling som bare en «fysisk» metode. Vi ser den som en biologisk og immunologisk hendelse. Den kan ikke bare drepe - den kan vekke. Og det gjør den til en av de mest kraftfulle verktøyene vi har i kampen mot kreft.
Kim Sypriansen
December 4, 2025 AT 20:16Det er fascinerende hvordan stråling ikke bare dreper, men faktisk vekker immunsystemet. Det er som om kroppen får en ny mappe med instruksjoner om hva som er farlig. Jeg tenker ofte på hvordan vi egentlig bare er samarbeidspartnere med våre egne celler - og nå ser vi at behandlingen kan hjelpe dem å samarbeide bedre.
Det er ikke bare fysikk, det er biologi som snakker til oss. Og det er vakrt.
Vi bør snakke mer om dette i skolen. Ikke bare om kreft, men om hvordan kroppen tenker.
Thorvald Wisdom
December 6, 2025 AT 10:19Å ja, selvfølgelig. Stråling er den store helgenen i kreftbehandling, mens folk fortsatt dør av masse andre sykdommer fordi vi ikke har råd til å teste alle mulige kombinasjoner. Men la oss feire at vi kan sende en stråle gjennom kroppen som faktisk har en plan. Det er jo ikke som om vi bare kaster en boks med røntgen på folk og håper for det beste.
Det er som å si at en koke er en vitenskapelig fremgang fordi han ikke brant opp kaffen. Grattis, vi er nå på nivå 2 av kokekunst.
Charlotte Ryngøye
December 7, 2025 AT 22:05Det er så trist at vi fortsatt bruker stråling som en slags støvsuger i kroppen. Hvis vi hadde investert 10% av pengene i å forstå epigenetikk i stedet for å bombe celler, hadde vi kanskje funnet en måte å stoppe kreft før den starter.
Men nei, la oss bare kaste mer energi på det som allerede er skadet. Klassisk norsk tankegang: Ikke løs problemet, ødelegg det med større kraft. Det er så elegant.
PS: Jeg leste hele artikkelen. Det var bra skrevet. Men det endrer ikke at vi er i en 1970-års paradigme.
Erling Jensen
December 9, 2025 AT 01:03Stråling er bare en del av et større system der folk med penger får behandling og folk uten får dø. Men la oss snakke om DNA-brudd i stedet for at 30% av befolkningen ikke har tilgang til en god onkolog. Det er vel lettere å snakke om celler enn om systemet som lar folk dø fordi de ikke har godkjenning til en ny medisin.
Det er som å forklare hvordan en bil har en motor, mens folk dør av sult på veien til bensinstasjonen. Men ja, la oss feire at motorer er smarte. 🤖
Christer Nordvik
December 10, 2025 AT 08:03Det her er en av de rareste og vakreste tingene jeg har lest på lenge. Stråling som vekker immunsystemet? Det er som om kroppen får en alarm som sier: "Hei, her er noe som ikke skal være her!"
Det gjør meg optimistisk. Ikke fordi vi har alle svarene, men fordi vi begynner å se på kreft som en samtale - ikke en krig.
Vi er ikke bare pasienter. Vi er del av et system. Og det er bra. 🙌
Astrid Aagjes
December 11, 2025 AT 13:03eg har lest dette tre ganger og jeg skjønner fortsatt ikke alt men jeg liker at de skriver på en måte som ikke gjør meg føle meg dum. det er ikke bare for nerder. det er for folk som vil forstå. og det betyr mye. 🤍
Reidun Øvrebotten
December 11, 2025 AT 13:40Åh, jeg må bare si at dette er en av de mest vakre forklaringene av strålebehandling jeg har lest. Det er som en dikt om kroppen - full av smerte, men også full av håp.
Det er ikke bare medisin. Det er poetisk. DNA som bryter seg, og så forsøker å bygge seg opp igjen. Og når det ikke klarer det, sender den ut en sang til immunsystemet. Det er så dypt.
Jeg har grått litt. Ikke av sorg, men av beundring. For hvordan kan vi være så flinke til å forstå noe så komplekst? Og likevel så dårlig til å gi alle tilgang til det?
Vi må bli bedre. Ikke bare i vitenskapen, men i hjertet.
Liv Hanlon
December 12, 2025 AT 11:32Ja, selvfølgelig - stråling er fantastisk. Men la oss ikke glemme at det er en behandling som ofte gjør folk så syke at de ønsker å dø. Og så får de en "immunologisk vekkelse" som kanskje fungerer for én av ti. Det er ikke en miracle. Det er et odds-spill med en høy pris.
Men ja, la oss feire at vi kan forklare det med flotte ord. Det er mye lettere enn å løse det.
Inger Quiggle
December 13, 2025 AT 03:20OMG JEG HAR KREFT OG HAR FÅTT STRÅLING OG DET ER SOM Å BLI SLÅTT MED EN BOKS AV KJEMIKALIER OG DERetter HØRE EN SANG FRA KROPPEN MIN. JEG HAR LITT TORMENT OG EN MÅNED AV SØVNLOSHET OG DETTE ER KJEMPEFLINKT Å SKRIVE OM SOM OM DET ER ET VAKKERT EVENTYR. JEG HATER Å VÆRE SÅ DRAAMA, MEN JEG HAR IKKE KUNNET SLÅ AV DETTE. 🌪️💔
Bjørn Lie
December 14, 2025 AT 12:57Det er viktig å huske at ikke alle har tilgang til de nyeste metodene. Ikke alle bor i Oslo og har en god lege. Jeg har sett folk i småbyer som må reise 300 km bare for å få en behandling.
Vi må ikke bare feire teknologien. Vi må også sørge for at den når alle. Det er ikke bare vitenskap. Det er rettighet.
Jonas Askvik Bjorheim
December 14, 2025 AT 15:42IMRT? SBRT? FLASH? Hva er det for en slags koding? Det er som å lese en manual for en robot som har lest for mye sci-fi. Jeg skjønner ikke ett ord, men det lyder veldig teknisk. Jeg tror jeg er for gammel for dette. Men det er kanskje bra at noen skjønner det. 😅
Petter Larsen Hellstrøm
December 16, 2025 AT 13:51Det er ikke bare teknologi. Det er forståelse. Og det er det som virkelig teller. Jeg har sett pasienter som har overlevd fordi de fikk en behandling som passet dem - ikke bare fordi den var ny, men fordi den var riktig.
Vi må slutte å se på stråling som en universal løsning. Den er et verktøy. Og som alle verktøy, må den brukes med kunnskap og omsorg.
Det er ikke bare om hva vi gjør. Det er om hvordan vi gjør det.
Liv ogier
December 17, 2025 AT 07:57Det er så mye smerte i dette. Ikke bare i cellene. Men i hjertene. Jeg har sett folk bli skjønt og så dø likevel. Og da kommer jeg tilbake til denne artikkelen og tenker: Hvorfor er det så vanskelig å hjelpe folk? Jeg føler meg så tom når jeg leser dette. 😔
ine beckerman
December 17, 2025 AT 09:47Stråling er ikke revolution. Det er en forbedring. Og vi har bare begynt. Men det er ikke et mirakel. Det er en kalkulasjon. Og vi har fortsatt ikke funnet ut av alt. Men vi prøver. Så det er noe. 🤷♀️
Kim Sypriansen
December 18, 2025 AT 18:24Det du sier om tilgang, Bjørn, er så viktig. Jeg tenker på hvordan vi i Norge har så mye, og likevel er det folk som blir glemt. Stråling kan være en kunst, men helse er et menneskerett.
Vi kan ikke bare feire teknologien og glemme at det er mennesker bak hver behandling. Det er ikke bare DNA som bryter. Det er liv som bryter. Og vi må se det.
Takk for at du sa det.