Hva er FDA's kontor for generiske legemidler?
Office of Generic Drugs (OGD) er et spesialisert kontor innenfor Center for Drug Evaluation and Research (CDER) ved U.S. Food and Drug Administration (FDA). Det er ansvarlig for å vurdere, godkjenne og overvåke alle generiske legemidler i USA. OGD ble oppgradert til et "superkontor" den 10. desember 2013, noe som ga det direkte rapporteringslinje til CDER-direktøren og økte dets myndighet og effektivitet.
Formålet med OGD er enkelt: sørge for at trygge, effektive og billige generiske legemidler er tilgjengelige for alle amerikanske borgere. Uten OGD ville mange pasienter ikke ha hatt tilgang til generiske alternativer til dyre merkevarelegemidler. Kontoret sikrer at et generisk legemiddel ikke bare inneholder samme virkestoff som merkevareproduktet, men også at det fungerer likt i kroppen, er like trygt og oppfyller høy kvalitetsstandard.
Hvordan er OGD oppbygd?
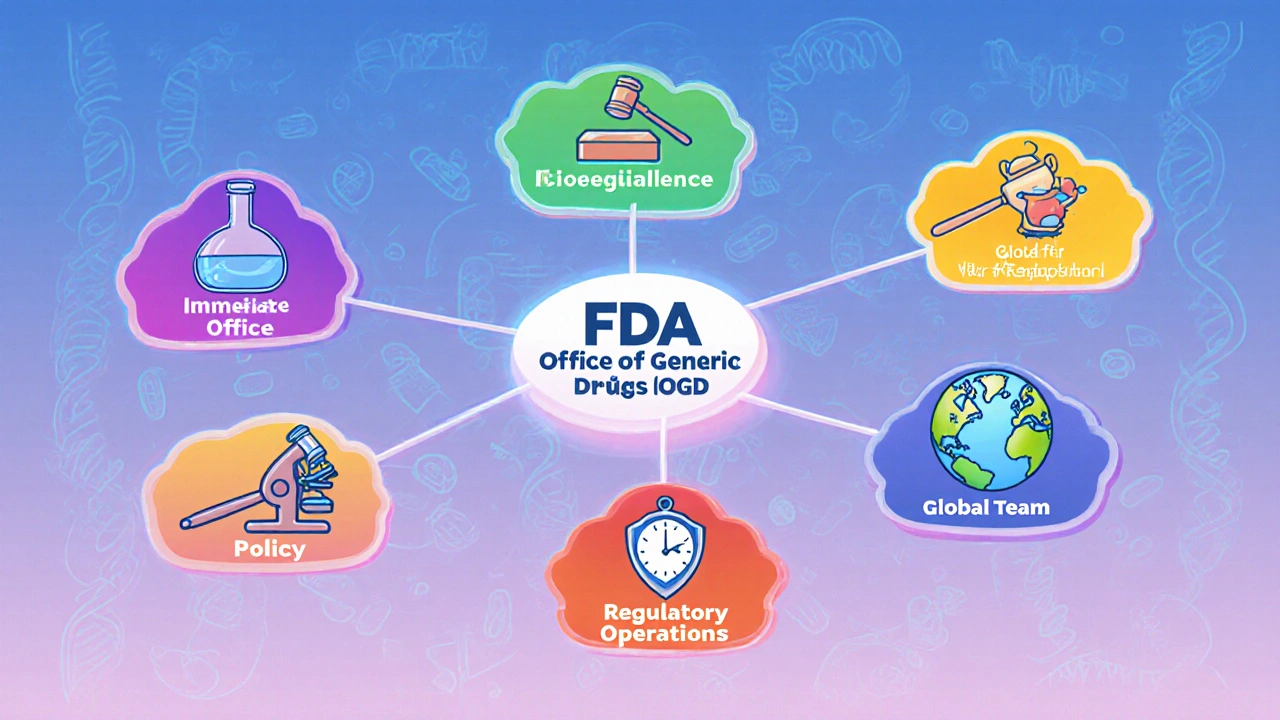
OGD er delt inn i seks deler: Immediate Office og fem underkontorer. Hvert underkontor har et spesifikt ansvar, men de arbeider sammen som et helhetlig system.
- Immediate Office (IO): Dette er ledelsen. Her finnes strategisk ledelse, juridisk og regulativ støtte, og det globale teamet for generiske legemidler. IO sørger for at alle deler av OGD arbeider i samme retning.
- Office of Bioequivalence (OB): Tester om generiske legemidler absorberes i kroppen på samme måte som merkevareproduktet. Dette er kritisk for å sikre at et generisk legemiddel virker likt. OB har også et team for legemiddelsikkerhet som overvåker bivirkninger.
- Office of Generic Drug Policy: Utvikler regler og retningslinjer for generiske legemidler. Her håndteres spørsmål knyttet til Hatch-Waxman Act, patentbeskyttelse og eksklusivitetsperioder.
- Office of Regulatory Operations (ORO): Har ansvar for daglig drift av vurderingsprosessen. Her jobber Regulatory Project Managers (RPMs) som følger opp hver søknad om godkjenning (ANDA) og sikrer at alle frister oppfylles.
- Office of Research and Standards (ORS): Utvikler vitenskapelige standarder for testing og kvalitetskontroll. Her jobber forskere med matematiske modeller og målinger for å forstå hvordan legemidler oppfører seg i kroppen.
- Office of Safety and Clinical Evaluation: Overvåker sikkerhet etter at legemidlene er på markedet. Dette inkluderer å analysere rapporter om bivirkninger og å samarbeide med helsepersonell for å identifisere potensielle risikoer.
Denne strukturen gjør det mulig for OGD å håndtere tusenvis av søknader hvert år - og gjøre det riktig. Hver del har spesialisert kompetanse, men alle er knyttet sammen gjennom felles mål og systemer.
Hva er ANDA og hvorfor er det viktig?
Alle generiske legemidler må søke om godkjenning gjennom en Abbreviated New Drug Application (ANDA). Det er en forenklet søknad sammenlignet med den omfattende søknaden som merkevareprodusenter må levere.
En ANDA trenger ikke å gjenta hele kliniske forsøk. I stedet må produsenten vise at legemidlet er bioekvivalent med det opprinnelige produktet. Det betyr at det inneholder samme virkestoff, i samme mengde, i samme form (f.eks. tablett, injeksjon) og at kroppen tar det opp på samme måte.
Regulatory Project Managers i OGD følger hver ANDA gjennom hele prosessen - fra innlevering til godkjenning. De sørger for at dokumentasjonen er komplett, at testene er gyldige og at kvaliteten er på høy nivå. OGD har faste frister for vurdering, satt av GDUFA, og må holde dem - ellers mister de pengene de får fra industrien.

Hva er GDUFA og hvordan finansieres arbeidet?
Generic Drug User Fee Amendments (GDUFA) er en lov som ble innført i 2012. Den tillater at produsenter av generiske legemidler betaler en avgift til FDA for hver søknad de levere.
Disse avgiftene finansierer hele vurderingsprosessen. Det betyr at OGD ikke bare avhenger av offentlige midler - det har en stabil inntekt som gjør det mulig å ansette flere eksperter, bruke bedre teknologi og redusere ventetider.
GDUFA har gjort det mulig for OGD å redusere ventetiden for godkjenning av generiske legemidler fra over tre år til under 10 måneder for de fleste søknader. Det har også gjort det lettere for nye aktører å komme inn på markedet, noe som øker konkurransen og senker prisen.
Hvordan påvirker Hatch-Waxman Act generiske legemidler?
Hatch-Waxman Act fra 1984 er en av de viktigste lovene for generiske legemidler i USA. Den skapte en balanse mellom innovasjon og tilgjengelighet.
Den ga merkevareprodusenter en periode med eksklusivitet (opptil 5 år) etter at et nytt legemiddel kom på markedet. Samtidig gav den generiske produsenter en vei til markedet ved å tillate dem å bruke data fra merkevareprodusenten - så lenge de ikke infringer på patenter.
OGD har en spesialavdeling - Division of Legal and Regulatory Support - som er eksperter på denne loven. De vurderer om en generisk produsent har riktig patenterklaring, om eksklusiviteten er pågående, og når et legemiddel faktisk kan godkjennes.
Denne avdelingen avgjør også om en generisk produsent kan komme inn først - og få 180 dagers eksklusivitet som belønning for å utfordre et patent. Dette er en viktig del av markedet, fordi den første generiske produsenten ofte får største del av salgene.

Hvordan sikrer OGD kvalitet og sikkerhet?
Det er ikke nok at et legemiddel inneholder riktig virkestoff. Det må også være rent, stabilt og produsert i godkjente anlegg.
OGD gjør kontrollbesøk i produksjonsanlegg over hele verden - fra India og Kina til USA og Europa. De sjekker om standardene for god produsksjon (GMP) blir overholdt. Hvis et anlegg ikke lever opp, kan godkjenningen trekkes tilbake.
Etter at et legemiddel er på markedet, overvåker OGD bivirkninger gjennom samarbeid med helsepersonell og pasienter. Hvis det oppdages et mønster med alvorlige bivirkninger, kan de kreve endringer i bruksanvisningen, legge til advarsler, eller til og med trekke legemidlet tilbake.
OGD arbeider også med Risk Evaluation and Mitigation Strategy (REMS) - spesielle sikkerhetsplaner for legemidler med høy risiko. Disse gjelder både merkevare- og generiske produkter, og OGD sikrer at alle produsenter følger de samme reglene.
Hvordan bidrar OGD til global helse?
OGD har et globalt team som samarbeider med reguleringsmyndigheter i Canada, EU, Japan og India. Dette er viktig fordi mange generiske legemidler produseres utenfor USA, men brukes av amerikanske pasienter.
Det globale teamet hjelper til med å forstå ulike regulative krav, forenkle godkjenninger og sikre at kvalitetsstandarder er like høye uansett hvor legemidlet er produsert. De jobber også med å bygge kapasitet i utviklingsland, slik at flere pasienter over hele verden får tilgang til trygge generiske legemidler.
Hvorfor er OGD viktig for deg?
Hvis du eller noen du kjenner bruker generiske legemidler, så er OGD den grunnen til at du kan betale 80-90 % mindre enn for merkevareproduktet.
Uten OGD ville det tatt år å få nye generiske legemidler på markedet. Det ville vært vanskeligere for nye produsenter å komme inn, og prisen ville vært høyere. Pasienter med kroniske sykdommer som diabetes, høyt blodtrykk eller depresjon ville hatt større vanskeligheter med å få tilgang til nødvendige legemidler.
OGD sikrer at du ikke må velge mellom å ta legemidlet eller å betale for det. Det er et system som fungerer - og det fungerer fordi det er godt bygd, godt finansiert og godt ledet.
Hva er forskjellen mellom et merkevarelegemiddel og et generisk legemiddel?
Det eneste faktiske forskjellen er navnet og prisen. Et generisk legemiddel inneholder samme virkestoff, i samme mengde, i samme form og gir samme effekt som merkevareproduktet. Det kan se litt annerledes ut, fordi patentene på farge og form er beskyttet, men det virker likt. Forskjellen i pris kommer av at generiske produsenter ikke må gjenta dyre kliniske forsøk.
Hvorfor tar det noen ganger så lenge å få et generisk legemiddel på markedet?
Selv om OGD har frister på under 10 måneder, kan det ta lengre hvis søknaden er kompleks, mangler informasjon, eller hvis det er patenter eller eksklusivitetsperioder som må avklares. Noen ganger må produsentene møte opp med nye data etter at søknaden er sendt inn. OGD må også prioritere legemidler som behandles i kriser - som legemidler mot antibiotika eller ved akutt legemiddelsvikt.
Er generiske legemidler like trygge som merkevareproduktet?
Ja. OGD krever at generiske legemidler oppfyller de samme strenge kvalitets-, sikkerhets- og effektivitetskravene som merkevareproduktet. De må vise bioekvivalens, produseres i godkjente anlegg og overholde samme standarder for stabilitet og renhet. Tausende studier og overvåkninger har vist at generiske legemidler er like trygge og effektive.
Kan jeg stole på generiske legemidler produsert i utlandet?
Ja - men bare hvis de er godkjent av FDA. OGD gjør regelmessige inspeksjoner i produksjonsanlegg over hele verden. Hvis et anlegg ikke lever opp til standardene, blir det ikke tillatt å eksportere til USA. Du kan sjekke om et legemiddel er godkjent ved å søke på FDA sin database for generiske legemidler.
Hvordan vet jeg om et legemiddel er et generisk alternativ?
På legemiddelforpakningen står det ofte navnet på virkestoffet i stedet for merkevaren. For eksempel: "Metformin" i stedet for "Glucophage". Apoteket vil også spørre deg om du vil ha det generiske alternativet, og det vil ofte være mye billigere. Du kan også sjekke på FDA sin nettsted for generiske legemidler for å se hvilke produkter som er godkjent.
Linn Tammaro
November 20, 2025 AT 22:49Det er faktisk ganske imponerende hvordan OGD har klart å redusere ventetiden til under 10 måneder. Jeg har en kjæreste som tar metformin, og hun sparte over 80% på resepten etter at det generiske kom på markedet. Det er ikke bare et spørsmål om penger – det er et spørsmål om liv og død for mange.
Siw Andersen
November 21, 2025 AT 14:41Åh, selvfølgelig. FDA er den hellige gral av legemiddelregulering. Men vi glemmer ofte at de også er en del av et system som er bygget på korrupsjon og industriefinansiering. GDUFA? Det er bare en smokescreen for at pharmaindustrien kan kjøpe seg fri fra ansvar. Hvor mange av de 10 månedene er egentlig bare forsinkelser for å la patentene utløpe?
Kaja Hertneck
November 21, 2025 AT 18:38Det er bare en ting som virkelig teller: norske pasienter får ikke tilgang til disse generiske legemidlene like raskt. Vi har en myndighet som er så treig at den ikke engang klarer å godkjenne et par tabletter i tide. OGD i USA? De har en motor. Vi har en skrivebordstue med kaffe og småkaker.
Kari Littleford
November 23, 2025 AT 12:11Jeg tenkte på dette etter jeg leste at OGD gjør inspeksjoner i India og Kina – det er jo veldig viktig, men jeg lurer på om det virkelig er like strengt som i EU. Jeg har lest at noen av de største produsentene der har hatt problemer med dokumentasjon og kvalitetskontroll. Er det bare meg som tror at vi burde ha en felles internasjonal standard, og ikke bare la FDA gjøre det hele? Det er ikke rettferdig å la en enkelt myndighet stå for hele verden sin helse.
Bjørn Ole Kjelsberg
November 24, 2025 AT 04:34Det er en myte at generiske legemidler er like trygge. Bioekvivalens er en statistisk gjetning – ikke en garanti. Hvor mange pasienter har faktisk opplevd at det generiske alternativet ikke fungerte? De blir ikke rapportert. Det er ikke fordi det ikke skjer – det er fordi systemet ikke vil høre det. Og så kommer de med denne fengselslignende 'GDUFA'-taktikken for å skape en illusjon av effektivitet. Det er ikke systemet som fungerer. Det er en maskin som er designet for å skjule feil.
Kristin Beam
November 25, 2025 AT 05:09Det er viktig å huske at mange av disse generiske legemidlene produseres i land som ikke har samme rettslige tradisjon som USA. Men OGDs globale team jobber faktisk veldig godt med å bygge opp kapasitet i disse regionene. Det er ikke bare kontroll – det er utvikling. Og det er det som virkelig skiller dem fra mange andre myndigheter.
Cathrine Damm
November 25, 2025 AT 22:12Har du noen gang tenkt på at FDA kanskje ikke er så uavhengig som de vil at vi skal tro? Hvorfor tror du at de plutselig ble så effektive etter at GDUFA kom inn? Det er ikke fordi de ble bedre – det er fordi de ble betalt. Og hvem betaler? Pharmaindustrien. Og hvem kontrollerer industrien? De samme som styrer politikken. Det er ikke et system. Det er et konsortium.
Dag Arild Mathisen
November 26, 2025 AT 19:52Det er viktig å forstå at bioekvivalens ikke betyr at alle reagerer likt – men det betyr at det er like sannsynlig at det fungerer som det originale. Jeg har jobbet med pasienter i 20 år, og jeg har sett at de fleste klarer seg bedre med generiske legemidler fordi de kan ta dem hver dag – fordi de kan skaffe dem. Det er ikke magi. Det er logikk.
alf hdez
November 27, 2025 AT 21:11Det er ganske fascinerende at en slik organisasjon kan fungere på denne måten – med så mange deler som må samarbeide. Det minner meg om et hjul med mange tannhjul – hvis ett faller ut, stopper alt. Og likevel – det fungerer. Det er en god lære om at systemer kan være komplekse og likevel virke. Vi bør lære mer av det her.
Hanne Røed
November 27, 2025 AT 21:37OGD: Office of Generic Drugs. Ikke: Office of Generic Drugs And Corporate Lobbyists. Det er viktig å skille mellom det som er offisielt, og det som er faktisk. Hvor mange av de 10 månedene er egentlig bare forsinkelser for å la patentene utløpe? Det er ikke bare om tid – det er om makt.
Kristin Cioffi-Duarte
November 28, 2025 AT 10:58Jeg tenker ofte på hvordan vi som samfunn vurderer verdi. Vi sier at et legemiddel er verdt det det koster – men vi glemmer at verdi ikke bare er pris. Det er tilgjengelighet. Det er sikkerhet. Det er mennesker som kan sove i natt fordi de ikke må velge mellom mat og legemiddel. OGD er ikke bare en myndighet – det er et symbol på at vi kan gjøre ting riktig, selv når det er vanskelig.
Theadora Benzing
November 30, 2025 AT 00:26Generiske legemidler er like gode. Ikke mer. Ikke mindre.
Stig .
December 1, 2025 AT 16:20Det er rart at folk tror at FDA er perfekt. Men det er bedre enn det vi har. Vi har ikke engang en helhetlig database for generiske legemidler i Norge. Hvorfor snakker vi ikke om det? Hvorfor er det bare enkelt å peke på USA og si 'de gjør det riktig' – men ikke spørre hvordan vi kan gjøre det bedre her?
Nils Heldal
December 1, 2025 AT 16:34Jeg synes det er viktig å ikke bare feire OGD, men også å forstå at det er et produkt av politisk vilje – ikke bare vitenskap. GDUFA ble ikke innført fordi folk plutselig ble mer oppmerksomme på helse – det ble innført fordi kongressen var presset av økonomiske press. Det er en balanse mellom marked og offentlig helse. Og det er ikke alltid en lett balanse. Men det fungerer. Og det er mer enn vi har i mange andre land.
kristine Itora
December 3, 2025 AT 14:40Det er ikke bare om legemidler. Det er om å gi folk mulighet. Og det er det som virkelig teller.