For mange år siden var det en selvfølge: for å bevise at et generisk legemiddel var like effektivt som et merkevareprodukt, måtte man teste det på mennesker. Hver bioekvivalensstudie krever 24-36 friske frivillige, koster mellom 500 000 og 2 millioner dollar, og tar minst seks måneder å gjennomføre. Men i dag er det mulig å unngå disse dyre og tidkrevende studiene - ikke ved å gjøre dem mindre, men ved å erstatte dem med en nøyaktig laboratorietest: IVIVC.
Hva er IVIVC?
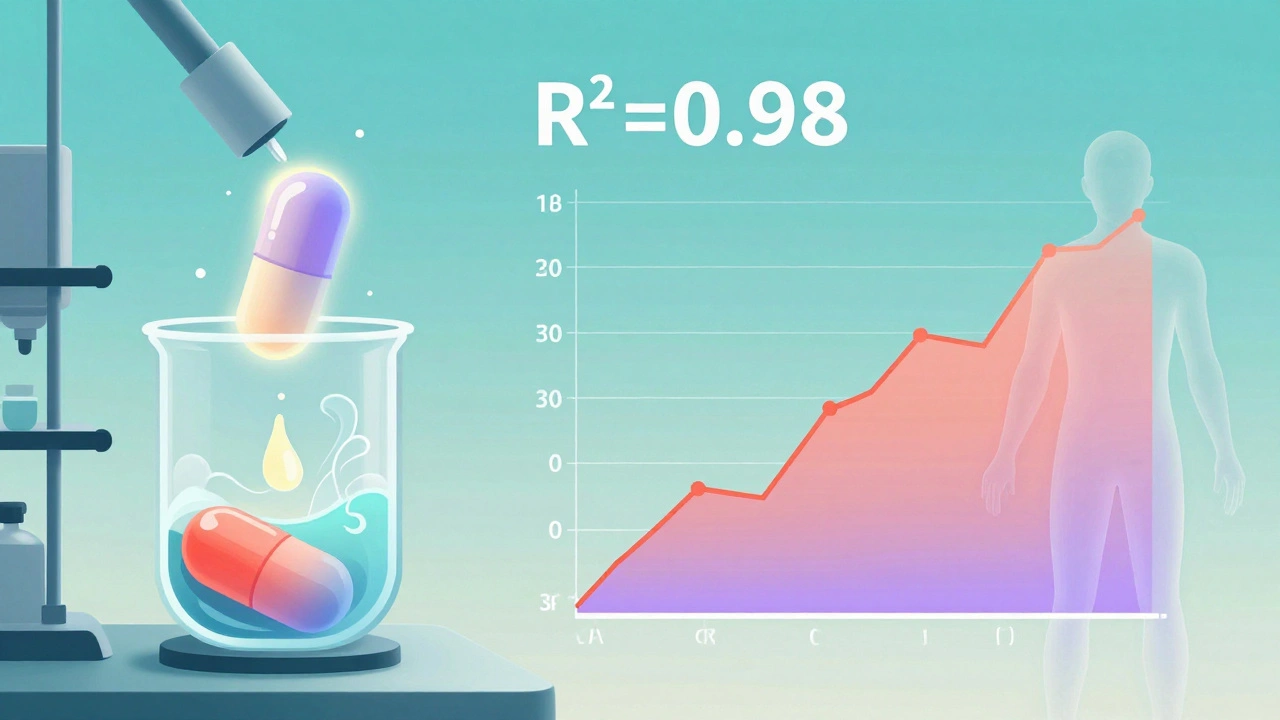
IVIVC står for In Vitro-In Vivo Correlation, eller på norsk: in-vitro-in-vivo-korrelasjon. Det er en matematisk modell som kobler sammen en enkel laboratorietest - vanligvis hvordan raskt et legemiddel oppløses i væske - med hvordan det faktisk oppfører seg i kroppen. Hvis modellen er god nok, kan du si: “Hvis oppløsningen i laboratoriet ser slik ut, så vil blodkonsentrasjonen i kroppen være slik.” Og da trenger du ikke lenger å ta blodprøver fra mennesker for å bevise at legemidlet virker.
Dette er ikke teori. Denne metoden ble anerkjent av USAs FDA i 1996, og siden da har den blitt en del av regulativ praksis i både USA og Europa. Men det er ikke bare en ny test. Det er en helt ny måte å tenke på legemiddelutvikling - fra å teste på mennesker til å stole på data fra en maskin.
Hvorfor er IVIVC så viktig?
For produsenter av generiske legemidler er IVIVC en kraftig redskap. Hver bioekvivalensstudie som kan unngås, sparer millioner av dollar. Et enkelt IVIVC-prosjekt kan redusere utviklingstiden med 6-12 måneder og spare 1-2 millioner dollar per legemiddel. Det er ikke bare økonomisk - det er også etisk. Mindre mennesker utsatt for blodprøver, mindre risiko, mindre tid i klinikk.
Men det er ikke bare for generiske legemidler. IVIVC brukes også når et legemiddel skal endres litt - for eksempel hvis du bytter leverandør av en hjelpestoff, endrer produksjonssted, eller justerer en formel. Uten IVIVC må du gjøre en ny bioekvivalensstudie for hver liten endring. Med IVIVC kan du bare vise at oppløsningsprofilen er den samme. Og da godkjenner reglene at legemidlet er like effektivt.
Hva er de ulike nivåene av IVIVC?
IVIVC er ikke én type modell. Den er delt inn i fire nivåer, og bare ett av dem er godkjent som standard for biowaiver.
- Nivå A: Den høyeste og beste formen. Den kobler hvert punkt i oppløsningskurven direkte til hvert punkt i blodkonsentrasjonskurven. Hvis oppløsningen er 30 % etter 1 time, så er blodkonsentrasjonen også nøyaktig som forventet. Den krever en korrelasjonskoeffisient (R²) over 0,95, og må kunne forutsi både AUC (total eksponering) og Cmax (maksimal konsentrasjon) med feilmargin på under 10-15 %. Dette er det eneste nivået som gir full biowaiver.
- Nivå B: Bruker gjennomsnittsverdier. Den sier ikke noe om hvert enkelt punkt, bare om gjennomsnittlig oppførsel. Ikke godkjent for biowaiver.
- Nivå C: Kobler ett enkelt tall - for eksempel hvor mye som er oppløst etter 1 time - til én blodparameter, som Cmax. Den kan brukes, men bare hvis du har flere slike punkter og god støtte. Den er lettere å lage, men mindre pålitelig.
- Muliple Level C: Flere punkter fra oppløsningen kobles til flere blodparametre. Kan godkjennes med ekstra bevis, men er mer feilfølsom.
For en biowaiver må du ha nivå A. Hvis du bare har nivå C, kan du ikke bare sende inn dokumentet og vente på godkjenning. Du må også vise at det ikke er noen skjulte faktorer som påvirker opptak - som mat, mage-tarm-systemets pH, eller individuelle forskjeller i absorpsjon.
Hvordan lages en IVIVC-modell?
Å lage en god IVIVC er ikke en enkel prosess. Det krever:
- Flere formelvarianter: Du må lage minst 3-5 forskjellige versjoner av legemidlet - med ulik oppløsningshastighet. Det kan være ved å endre mengden av en hjelpestoff, kornstørrelse, eller konsistens.
- Detaljerte kliniske studier: Hver variant må testes på 12-24 friske frivillige. Blodprøver tas ofte hvert 15-30 minutt i 24-48 timer. Det er mange prøver. Og de må være nøyaktige.
- En diskriminerende oppløsningsmetode: Testen må kunne skille mellom små forskjeller. Hvis to formeler oppløses likt i testen, men forskjellig i kroppen, så er metoden dårlig. Standard metoder som USP Apparatus 1 eller 2 brukes ofte, men for komplekse legemidler må du bruke biorelevante løsninger - med gallesyrer, pH-skift, og andre faktorer som etterligner mage og tarm.
- En god modell: Du trenger en statistiker som forstår både farmasøytikk og farmakokinetikk. Bare 15 % av farmasøytiske selskaper har denne kompetansen inne i selskapet. Mange må leie inn eksterne konsulenter.
Prosjektet tar 12-18 måneder. Det er ikke noe du starter på en fredag. Det krever planlegging, ressurser, og tålmodighet.
Hvorfor mislykkes mange IVIVC-prosjekter?
En undersøkelse fra 2022 viste at 68 % av farmasøytiske selskaper har prøvd å lage en IVIVC. Bare 29 % klarte å få den godkjent på første forsøk. Hvorfor?
- 76 %: Ikke nok variasjon i formelene. De testet bare to eller tre varianter - ikke nok til å vise en klar sammenheng.
- 63 %: Oppløsningsmetoden var ikke diskriminerende nok. Den kunne ikke skille mellom små, men viktige forskjeller.
- 52 %: Blodprøvene var for få eller for dårlig samlet. Hvis du ikke har nok datapunkter, kan du ikke lage en god modell.
- 82 %: Oppløsningsbetingelsene var ikke fysiologiske. De testet i ren vann eller enkle bufferløsninger - ikke i løsninger som likner mage-tarm-systemet. Det er den største grunnen til at IVIVC feiler.
Et eksempel: Et selskap brukte 18 måneder og 1,2 millioner dollar på en IVIVC for et modifisert frigjørende legemiddel. Da de testet modellen med mat - altså når pasienten spiste før å ta legemidlet - sviktet modellen. Den forutsa feil konsentrasjon. De måtte kassere alt og starte på nytt.
Hva er forskjellen mellom IVIVC og BCS?
Det er en vanlig forvirring. BCS (Biopharmaceutics Classification System) er en annen måte å få biowaiver på - men bare for visse legemidler.
BCS klassifiserer legemidler i fire grupper basert på deres oppløselighet og gjennomgångsevne. Hvis et legemiddel er:
- Klasse I: Høy oppløselighet og høy gjennomgångsevne - da kan du ofte unngå bioekvivalensstudier bare ved å vise at oppløsningsprofilen er lik.
- Klasse II-IV: Lav oppløselighet eller lav gjennomgångsevne - da må du bruke IVIVC eller gjøre en full studie.
Men BCS fungerer bare for umiddelbar frigjøring. Hvis du har et legemiddel som frigjør stoffet over 12 timer - som en langvirksom pille for høyt blodtrykk - da er BCS ikke nok. Da må du bruke IVIVC.
Hvordan ser fremtiden ut?
IVIVC er ikke en forbigående trend. Den vokser. Fra 2018 til 2022 økte antallet IVIVC-forespørsler til FDA med 35 %. Godkjenningssatsen steg fra 15 % til 42 %. Det betyr at bedrifter lærer å gjøre det riktig.
Det nye i 2025 er:
- Biorelevante testmetoder: Mer enn 75 % av nye IVIVC-prosjekter vil bruke løsninger som etterligner mage-tarm-systemet - med gallesyrer, pH-skift, og magesekkens bevegelser. Dette er nå standard for komplekse legemidler.
- Maskinlæring: FDA og EMA tester nå AI-modeller som kan finne korrelasjoner i store datamengder. Det kan gjøre modelleringen raskere og mer nøyaktig.
- Utvidelse til andre legemiddelformer: I juni 2023 gav FDA en utkastveiledning for IVIVC til topiske legemidler - kremmer og salver. Det er første gang noen forsøker å bruke denne metoden utenom piller og kapsler.
- Implantater og injeksjoner: EMA og FDA holder nå workshopper om hvordan IVIVC kan brukes til legemidler som settes inn i kroppen - som implante eller injeksjonskapsler. Det er vanskelig, men mulig.
McKinsey forutsier at IVIVC vil stå for 35-40 % av alle godkjenninger av modifiserte legemidler i 2027 - opp fra 22 % i 2022. Det betyr at i løpet av fem år vil de fleste generiske langvirksomme piller ikke trenge en eneste bioekvivalensstudie.

Hva er grensene?
IVIVC er ikke en løsning for alle. Det er ikke lov å bruke det for:
- Legemidler med smal terapeutisk indeks: Hvis en liten forskjell i konsentrasjon kan føre til død eller alvorlig skade - som med warfarin eller lithium - så må du teste på mennesker.
- Legemidler med ikke-lineær opptak: Hvis kroppen ikke behandler legemidlet på en jevn måte - for eksempel når det blir mettet - så kan modellen ikke forutsi riktig.
- Legemidler som avhenger av tarmmikrober: Hvis opptaket avhenger av bakterier i tarmen - som noen antibiotika - så kan du ikke simulere det i en kolbe.
For disse legemidlene er in-vivo-testing fortsatt nødvendig. Men for de fleste andre - spesielt generiske piller med kontrollert frigjøring - er IVIVC nå den beste og mest pålitelige veien frem.
Hvem bruker IVIVC?
Det er ikke alle som har råd til det. Bare fem av de ti største generiske produsentene - Teva, Mylan, Sandoz, Sun Pharma og Lupin - har egne IVIVC-team. De andre leverer ofte til konsulenter. Alturas Analytics og Pion har nå en suksessrate på 60-70 % for nivå A-modeller - fordi de spesialiserer seg på det. De vet hva som virker.
En leder fra Teva sa en gang: “Vi brukte 14 måneder og tre formelvarianter på vår generiske oxycodon-pille. Men vi sparte fem bioekvivalensstudier - og det betydde millioner i besparelser.”
Men det er også eksempler på fiasko. En forsker på Reddit skrev at de kastet et IVIVC-prosjekt etter 1,2 millioner dollar og 18 måneder. “Modellen fungerte i laboratoriet. Men ikke i virkeligheten.”
Det er en viktig lære: IVIVC er ikke en “black box”. Den må forstås. Den må valideres. Og den må være fysiologisk sann.
Hva må du gjøre for å bruke IVIVC?
Om du er en farmasøytisk produsent, og du tenker på å bruke IVIVC:
- Start tidlig: Ikke vent til du har ferdig formelen. Start når du har prototype. Det er lettere å justere formelen under utvikling enn å prøve å rette opp en feil etter at du har testet på mennesker.
- Brug biorelevante metoder: Ikke bruk bare vann og pH 6,8. Bruk løsninger som etterligner tarmen. Det er ikke valgfritt - det er krav.
- Test mange varianter: Ikke bare to eller tre. Du trenger minst fire-fem forskjellige versjoner med tydelig forskjell i oppløsning.
- Samarbeid med eksperter: Hvis du ikke har en farmakokinetiker i huset, leie inn en. Det er billigere enn å gjøre en bioekvivalensstudie.
- Valider, valider, valider: Test modellen med data du ikke brukte til å bygge den. Test den med mat. Test den med ulike pH-verdier. Hvis den ikke holder, så er den ikke god nok.
IVIVC er ikke en enkel løsning. Men den er den eneste måten å komme forbi de dyre og tidkrevende menneskebaserte studiene. Og for mange legemidler - spesielt de som brukes hver dag av millioner av mennesker - er det ikke bare en bedre måte. Det er den eneste rimelige måten.
Hva er forskjellen mellom IVIVC og en vanlig oppløsningsprøve?
En vanlig oppløsningsprøve sier bare: “Hvor mye legemiddel har løst seg opp etter 30 minutter?” Den sjekker kvalitet, men ikke effekt. IVIVC kobler denne oppløsningen direkte til hva som skjer i kroppen - blodkonsentrasjonen over tid. Det er en prediksjonsmodell, ikke bare en sjekkliste.
Kan jeg bruke IVIVC til alle typer legemidler?
Nei. IVIVC fungerer best for munnlege midler med kontrollert frigjøring - som langvirksomme piller. Den fungerer dårlig for legemidler med smal terapeutisk indeks, ikke-lineær opptak, eller som avhenger av tarmmikrober. For topiske legemidler (kremmer) og injeksjoner er det nyttig, men det er fortsatt i utvikling.
Hvorfor er biorelevante oppløsningsmetoder så viktige?
Fordi kroppen ikke er en kolbe med rent vann. I tarmen er det gallesyrer, forskjellig pH, bevegelser og mat. Hvis du tester i en enkel løsning, så kan du få en god oppløsning - men det betyr ikke at legemidlet vil bli opptatt i kroppen. Biorelevante metoder etterligner dette, og derfor er de nødvendige for å lage en pålitelig IVIVC.
Hvor mye sparer man med en IVIVC-biowaiver?
En enkelt bioekvivalensstudie koster mellom 500 000 og 2 millioner dollar. Hvis du kan unngå fem slike studier - for eksempel for post-approval endringer - så sparer du 2,5-10 millioner dollar. Det er ikke bare penger. Det er også tid. Du slipper å vente 6-12 måneder for hver studie.
Er IVIVC godkjent i Europa?
Ja. Den europeiske legemiddelmyndigheten (EMA) aksepterer IVIVC i sin retningslinje for bioekvivalens fra 2012. Men de krever at modellen er robust, og at den er validert i ulike fysiologiske forhold. Det er ikke nok med en god modell - den må holde under virkelige forhold.
Tuva Langjord
December 7, 2025 AT 15:08Endelig no som skriver om dette på en måte som faktisk forstås! 🙌 IVIVC er som å ha en superkraft i farmasøytikk - du slipper å piske ut frivillige for å teste piller. Det er ikke bare smart, det er menneskelig. Jeg har sett folk bli stressa til døde i klinikk, og nå kan vi unngå det. Hva er ikke å elske teknologi som gjør verden bedre? 💪
Kristin Berlenbach
December 8, 2025 AT 22:35Ja, selvfølgelig. Fordi vi aldri har sett at maskiner feiler. 🤖 En modell som sier ‘hvis det løser seg i vann, så vil kroppen ikke dø’ - det er jo bare en drøm fra Big Pharma og FDA. Når kommer den første dødsfallet fra en biowaiver? Jeg venter. Og jeg har kameraet på. 📸
Kaja Moll
December 10, 2025 AT 05:09Det er ikke teknologi det handler om. Det er kontroll. De vil at vi skal stole på data - men hvem har skrevet algoritmen? Hvilke laboratorier? Hvilke banker eier selskapene? IVIVC er ikke en løsning. Det er en overgang til en verden der du ikke har noe å si om hva du tar. Og det er ikke bare farlig. Det er mørkt.
Kari Keuru
December 11, 2025 AT 05:55Det er viktig å presisere at nivå A IVIVC ikke bare er ‘godkjent’ - det er det eneste nivået som gir biowaiver. Alle andre nivåer krever ekstra dokumentasjon, og mange selskaper glemmer dette. Det er ikke bare teknisk feil - det er regulativt uansvarlig. Ikke bare fordi det er ‘kult’ med AI, men fordi det kan få folk til å tro at det er nok med en enkel test.
Edwin Marte
December 13, 2025 AT 03:04Det er så rart at folk fremdeles tror at biowaiver er ‘enkel’. Du trenger ikke bare en modell - du trenger en helt ny organisasjonskultur. Jeg har sett selskaper bruke 2 millioner på en IVIVC og så feile fordi de ikke hadde en farmakokinetiker i rommet. Det er ikke en IT-prosjekt. Det er en vitenskapelig krig. Og de som ikke forstår det, skal ikke være med i spillet.
Kathrine Oster
December 14, 2025 AT 02:17Det som virkelig rører meg er at vi nå kan spare mennesker fra blodprøver. Ikke bare fordi det er billigere. Men fordi det er riktig. En liten endring i en formel - og du slipper å sette noen i en klinikk i 48 timer. Det er ikke bare effektivitet. Det er moral. Og det er viktig å huske det.
Sverre Beisland
December 14, 2025 AT 15:29Det er lett å bli begeistret for IVIVC... men jeg tror vi må være forsiktige. Det er lett å tro at en modell er ‘god’ når den fungerer i lab. Men kroppen er ikke en kolbe. Og hvis vi begynner å stole for mye, så risikerer vi å glemme det enkle: mennesker er komplekse. Ikke bare data.
Siri Larson
December 16, 2025 AT 13:50Det er så bra at EMA og FDA tar dette alvorlig. 🤍 Jeg jobber med generiske legemidler, og det er en kamp hver dag å få til det riktige. Men når du ser en modell som faktisk fungerer - og sparer tid og penger - så blir du glad. Ikke bare for selskapet. Men for pasientene.
Rune Forsberg Hansen
December 17, 2025 AT 21:31Det er viktig å merke seg at biorelevante oppløsningsmetoder ikke er en ‘valgfri’ forbedring - de er en krav i både EMA og FDA-veiledningene fra 2012 og 2013. Det er ikke nok med USP Apparatus 2 og pH 6.8. Det må være gallesyrer, pH-skift, og eventuelt en simulert peristaltikk. Hvis du ikke gjør det, så er ikke modellen IVIVC - den er bare en oppløsningsprøve. Og det er ikke akseptabelt.
Asbjørn Dyrendal
December 18, 2025 AT 23:01Det er som å se en robot lage kaffe. Du tenker: ‘Wow, det er smart!’ Men så ser du at den glemmer å legge til sukker. Det er ikke fordi roboten er dum - det er fordi vi ikke sa nok. IVIVC er det samme. Det er ikke teknologien som feiler. Det er oss som ikke stiller de riktige spørsmålene.
Kristian Ponya
December 20, 2025 AT 21:57Det som er viktig her, er ikke at vi kan unngå menneskebaserte studier. Det er at vi kan gjøre det riktig. Når du sparer millioner, så må du også spara liv. Og det gjør du bare hvis modellen er sann. Ikke bare statistisk god. Men fysiologisk sann. Det er forskjellen mellom å teste og å forstå.
Jeanett Nekkoy
December 22, 2025 AT 19:55har prøvd å lage ivivc og det er ikke lett. vi brukte 18 måneder og kastet alt. det var ikke fordi vi var dumme. det var fordi vi brukte vann. ikke biorelevante løsninger. jeg tror mange tror det er en ‘formel’ men det er mer som å forstå kroppen. og det er ikke bare tall. det er følelser. og tid. og feil. og nytt forsøk.
Kim Sypriansen
December 24, 2025 AT 02:12Det er fascinerende hvordan vi flytter fra å teste på mennesker til å teste på data. Men jeg lurer på om vi glemmer at mennesker ikke er data. Hvis en modell sier at to piller er like, men én gir hodepine og den andre ikke - så er det ikke like. Og det er ikke bare statistikk. Det er mennesker.
Thorvald Wisdom
December 25, 2025 AT 20:23IVIVC? Ja, selvfølgelig. Vi bruker AI for å skrive svar på Reddit, så hvorfor ikke for å avgjøre om folk lever eller dør? 😏 Hva er neste steg? AI som skriver resepter? Algoritmer som sier ‘ta to piller og ring en advokat’? Hva er egentlig forskjellen mellom en farmasøytisk modell og en ChatGPT som sier ‘du er kanskje syk’?
Erling Jensen
December 27, 2025 AT 03:38Det er ikke teknologi som er problemet. Det er at vi har tillatt at de som eier laboratoriene, også eier reguleringen. De skriver veiledningene. De finansierer forskningen. Og så sier de: ‘Det er trygt’. Men hvis du ikke har råd til å gjøre det riktig - så får du ikke lov til å lage legemidler. Og det er ikke et spørsmål om vitenskap. Det er et spørsmål om makt.